城市大學首席及常務副校長李振聲表示,內地學生受騙情況同其他本地院校差不多,校方在多方面協助同學減少受騙,相信新學年情況會好轉。

香港城市大學。巴士的報圖片
李振聲出席傳媒春茗說,在學生來港前就告知同學及家長注意事項,校內有很多宣傳海報和老師講解,校方亦分別同內地和香港電信商合作,開發人工智能軟件堵截騙徒電話,以及避免向同學開設連續的手機號碼,但不會同中介合作向學生宣傳教育,因為難分辨好或壞的中介,亦不想商業化。

香港城市大學。FB圖片
他表示,新學年開始所有同學開學前須完成防騙問卷,如果警方早一步在學生申請簽註時已經給予問卷,校方表示認同及支持。
香港城市大學科研團隊早前獲「產學研1+計劃」撥款資助,研製新型半導體晶片封裝材料,旨在解決三維積體電路(3DIC)半導體晶片封裝中的金屬化挑戰。

城大系統工程學系馮憲平帶領研究團隊,開發新材料以應對3DIC半導體晶片封裝中的金屬化挑戰。圖右起為鉑識科技研發經理牟凱鈺、城大研究助理張攸雪、鉑識科技研發經理袁牧鋒及行政總裁黃榆婷。(圖片來源:香港城市大學)
團隊將通過研製一系列可用於電鍍銅的專利化學添加劑,從而確保晶片堆疊之間的連接更快速及穩定,提高晶片效能,並計劃於2026年建立自動化智能生產線。隨着人工智能(AI)、高效能運算(HPC)及 5G通訊等新興技術迅速發展,業界對晶片效能及可靠性的要求也日漸提高。
由城大系統工程學系馮憲平領導的「化學添加劑優化電鍍銅在先進電子封裝和三維積體電路中的應用」,為第二批獲中華人民共和國香港特別行政區政府「產學研1+計劃」(RAISe+ Scheme)資助的項目。團隊將通過計劃加速科研成果的商業化、增加產業應用,助力香港在全球先進半導體供應鏈市場佔據重要席位。
三維積體電路與先進封裝技術的挑戰
現時的半導體產業之中,電晶體的數量是提升運算效能與表現的關鍵指標,但隨着市場對電晶體數量的追求不斷增加,晶片設計因而面對空間限制、耗能、散熱困難和訊號延誤等不同問題。
至於3DIC技術是通過垂直堆疊的方式來整合(封裝)多顆電晶體,克服傳統平面連接結構所帶來的限制,將積體電路的架構由二維(2D)轉化為三維(3D),從而提升半導體晶片的性能、減少功耗,並在相同面積上附載更多電晶體,提升運算能力。
此項技術的關鍵是利用「矽穿孔(TSV)」結構、重佈線層(RDL),及以「銅對銅(Cu-Cu)鍵合」的方式垂直地連接電晶體,這對促進各層之間的信號傳遞、電力分配也至為重要。然而,若要持續縮小線寬尺寸與間距,鍵合(bonding)溫度過高、銅表面氧化以及電遷移壽命等問題,仍然是下一代3DIC及先進封裝技術發展的重要挑戰。
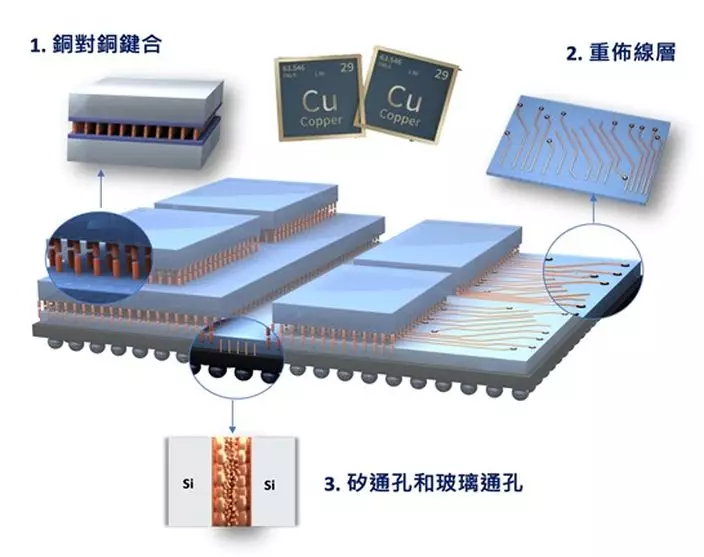
3DIC先進封裝示意圖,展示銅對銅鍵合、重佈線層、矽/玻璃通孔等關鍵金屬互連結構。城大團隊致力開發可精準控制材料微結構的電鍍銅溶液,應對3DIC封裝技術的金屬化難題。(圖片來源:香港城市大學)
四項關鍵技術提升穩定性及效能
為解決上述難題,團隊專注於研究封裝材料的解決方案,包括開發多種電鍍銅物料,透過專利的化學添加劑精確控制銅層的微結構,以提升 3DIC、玻璃基板和先進晶片封裝的生產和效能。
針對2.5D及3DIC封裝技術中金屬互連的四項關鍵技術包括:
1. 亞穩態銅(MS-Cu):透過納米晶粒銅結構,實現低溫的「銅對銅鍵合」方案,減少因高溫對溫度敏感元件帶來的傷害,並保持3D堆疊技術的穩定性。
2. 動態共價鍵塗層材料(DCB-coating):可防止銅表面氧化,並易於在「銅對銅鍵合」前去除,以確保高質量和乾淨的鍵合界面。
3. 結構穩定銅(SS-Cu):透過銅的複合微結構設計,可提高對表面腐蝕和電遷移(即電流引起原子移動,使物料形成空孔而導致裝置故障等問題)的抵抗力,確保高密度「重佈線層」的持續可靠性。
4. 納米粒子硫橋表面處理(NP-S):為玻璃基板進行金屬化製程,可增強電鍍銅在玻璃通孔(TGV)上的附著力,令玻璃成為新一代高頻電子器件的基板材料。
未來三年,團隊將致力建立一條智能生產線,並將專用添加劑和化學物的產量提升至每月兩噸。
馮憲平說:「團隊的研究為3DIC封裝技術的『銅對銅鍵合』提供全新的解決方案,所開發的材料及塗層使電晶體的連接過程更清潔、快速和可靠,可取代現有的傳統及高溫製程。這項技術改變了敏感元件的堆疊和保護方式,有效提高3DIC技術在下一代先進半導體產業的應用潛力。」

城大系統工程學系馮憲平教授(左三)帶領的研究項目在日前獲批「產學研1+計劃」資助。(圖片來源:香港城市大學)
促進人才、專利及產業發展
團隊不但致力推動科研創新,亦計劃與本地和國際企業合作,擴大技術在人工智能、電訊、汽車及消費電子產品中的應用,同時將申請四至十項專利,以提高科研轉化落地的機會,對半導體產業和整體社會作出貢獻。
馮憲平補充說:「團隊一直專注於先進半導體封裝材料技術的研究。通過『產學研1+計劃』,我們不但希望可建立更多專利和提升生產能力,更期望藉以培育更多年輕科研人才,為本地及全球半導體市場提供具有競爭力的解決方案。」
另外,團隊在城大創新創業計劃「HK Tech 300」的支持下成立了初創企業「鉑識科技」(Doctech),並於 2023 年獲頒達 100 萬港元的天使基金投資。其初創旨在成為下一代半導體製造和封裝行業的電鍍化學品與技術供應商,將城大的科研技術轉化為具影響力的產品應用。













