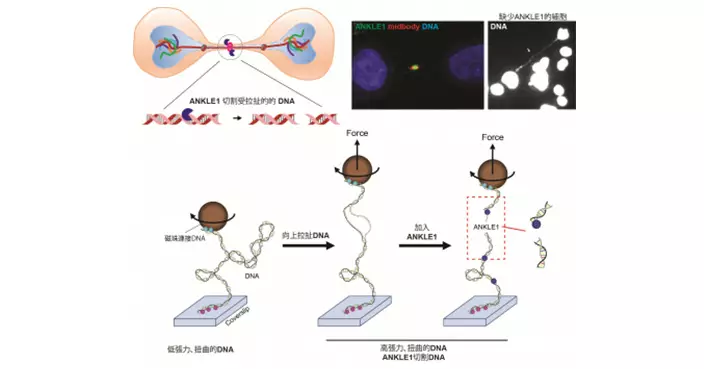
香港科技大學(科大)成功研發創新人工智能(AI) 系統 SmartPath, 革新癌症病理診療全流程。系統由科大計算機科學及工程學系和化學及生物工程學系助理教授兼醫工交叉聯合創新中心主任陳浩教授帶領的團隊所開發,整合臨床診斷、分型、生物標記物量化、治療評估及預後跟進功能,涵蓋多種癌症類型,以加快診斷速度,為患者提供更個人化的治療方案。
SmartPath 建基於全球其中一個規模最大及最多元的病理數據集,涵蓋 34 種主要人體組織部位、逾50 萬張全切片影像。系統可輔助專業醫療人員執行逾百項臨床任務,包括癌症病情分級、分型、治療反應評估、存活率預測,以及生成詳細病理報告等。
系統的關鍵突破在於能通過綜合病理基礎模型框架,精準診斷多種香港發病率最高的癌症,包括肺癌、乳腺癌、大腸癌及胃癌。
創新功能一站式支援臨床診療全流程
SmartPath 系統的核心能力由兩大整合式 AI 模型驅動:
• 卓越的跨癌種通用能力: 系統核心的通用病理基礎模型(GPFM)提供了統一框架,能精準識別不同腫瘤類型及癌症亞型與生物標記物量化。該系統不僅能進行診斷,更能預測患者的生存期及評估潛在治療反應,為個人化治療奠定基於數據的基礎。
• 多模態智能深化病理分析: 系統另一重要的多模態全切片病理基礎模型(mSTAR)整合了病理影像及海量的文字數據,包括病理報告及轉錄組學數據,可在短短數分鐘內自動生成資料詳盡的病理報告,並具備視覺諮詢功能,讓病理學家能針對切片細節提問。
• 無縫銜接臨床工作流程: SmartPath 提供端到端解決方案,全面優化癌症診療周期——從腫瘤切片快速初篩分析、風險預警到自動生成報告,進一步簡化癌症護理周期的臨床工作流程。這有助紓緩診斷瓶頸,讓病理專家專注於重大診斷決策及分析複雜病例。
領導研發團隊的陳浩教授表示:「SmartPath 的開發有賴與頂尖臨床機構的緊密合作,現時香港及中國內地逾十間頂尖醫院參與嚴格驗證,測試系統於真實臨床任務及多樣化患者群體中的性能表現。」
他補充:「結果顯示,SmartPath 在大多數基準任務中持續位居榜首,尤其在惡性腫瘤識別及治療反應預測等關鍵領域展現出卓越的準確性。持續的實戰數據更形成強大的反饋循環,有效促進機器學習的過程,使算法能持續優化,以提升系統診斷準確度與預測能力。SmartPath 並非靜態工具,而是會隨着每次臨床應用而持續演進的系統,為智能個人化醫療樹立新標準。」
嚴謹臨床試驗證卓越性能
研究團隊一直於中國內地和香港多家頂尖醫院就 SmartPath 進行多中心臨床驗證。經全面的基準測試後,系統表現顯著比現有模型優勝。根據南方醫院近期進行的前瞻性研究,SmartPath 在診斷肺癌、乳癌、結直腸癌等多種癌症類型中表現優異,整體準確率超過 95%。這些結果充分證明 SmartPath 有助提升診斷準確度、可靠預測存活期,以及快速生成報告的能力。
南方醫院病理科主任暨南方醫科大學基礎醫學院病理學系教授梁莉教授讚賞 SmartPath 的臨床驗證表現,並表示:「從近期 SmartPath 的初步試驗發現,系統能顯著提升惡性腫瘤識別的準確度,並提供可靠的預後預測,表現令人非常鼓舞。系統具備快速生成資料詳盡的初步報告功能,能大大縮短診斷周期,對於分秒必爭的癌症個案尤其重要。SmartPath 讓我們見證病理學的未來,通過這個 AI 驅動的系統可無縫融合臨床流程,增強診斷精準度,並輔助病理專家制定以數據驅動的個人化治療方案。」
由科大團隊研發的系統與框架為相關領域樹立新標準,提供強大及可擴展的研究基礎,以促進全球計算病理學和智能醫療未來的研究發展。研究團隊亦正逐步加強 SmartPath 的功能,以覆蓋更多癌症類型,重點針對那些較罕見及基因較複雜的惡性腫瘤,目標提升系統的預測模型,實現更具針對性的治療策略與患者分層,推動精準醫療的發展。
SmartPath 部分核心技術的研究成果近日已於頂尖學術期刊《自然生物醫學工程》上發表。

科大計算機科學及工程學系和化學及生物工程學系助理教授兼醫工交叉聯合創新中心主任陳浩教授(右)與南方醫院病理科主任暨南方醫科大學基礎醫學院病理學系教授梁莉教授(左)合影。

陳浩教授(右二)、梁莉教授(左二)與兩位科大研究團隊成員馬嘉波(左一)及徐映雪(右一)合影。

陳浩教授介紹其團隊最新研發的創新 AI 病理系統 SmartPath, 革新癌症病理診療全流程。
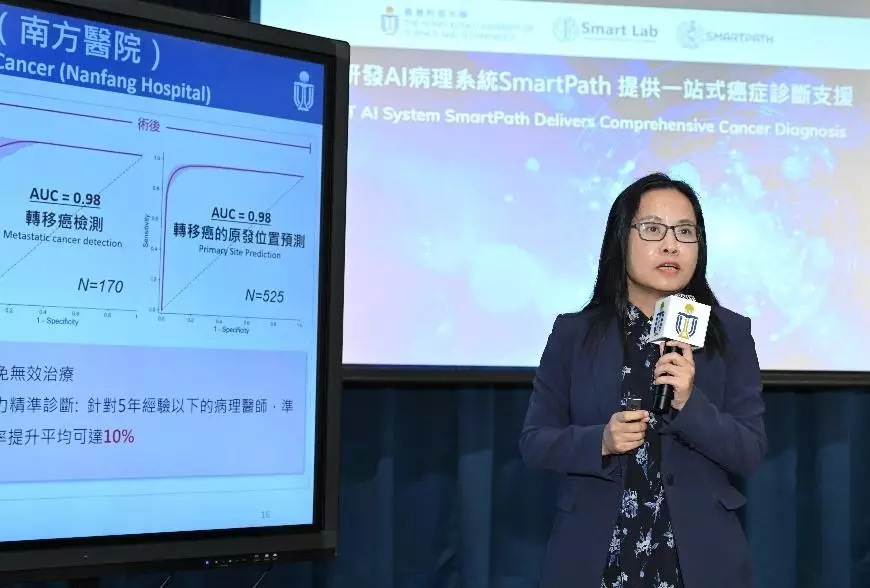
梁莉教授分享 SmartPath 系統在南方醫院進行的前瞻性臨床驗證結果。

陳浩教授(前排右四)與梁莉教授(前排左四)及雙方團隊成員合影。