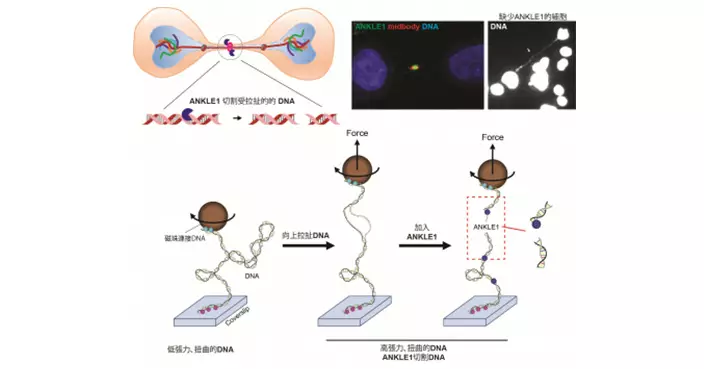
科大結構生物學家聯同港大醫學院與新發傳染病國家重點實驗室的研究人員已證明,源自本地 mRNA疫苗接種者、針對SARS-CoV-2 Omicron變異株的廣譜中和抗體ZCB11,對所有受關注變異株,包括當前主要流行的Omicron BA.1、BA.1.1 和 BA.2,均顯示出有效的抗病毒活性。更重要的是,使用ZCB11預防或治療Omicron病毒,可保護敘利亞倉鼠的肺部免受攻擊。相關研究論文已在《自然通訊》線上發表。

科大理學院生命科學部助理教授黨尚宇教授(左)及港大愛滋病研究所所長兼港大醫學院臨床醫學學院微生物學系陳志偉教授(右)。
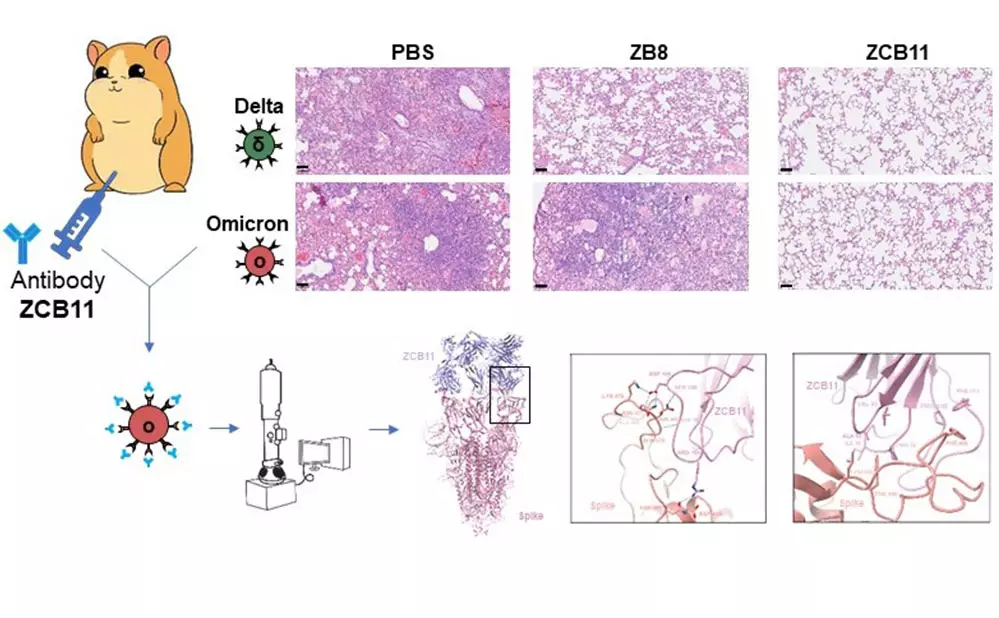
這項研究中,港大醫學院團隊建立一個高效的抗體克隆技術平台。該平台可以從單一的記憶B細胞中克隆出天然配對的人體抗體基因。利用這項技術,該研究團隊篩選了香港地區34位BNT162b2疫苗接種者的樣本,從中成功發現了抗體ZCB11,並通過假病毒和活病毒測試,證明ZCB11能夠中和所有VOCs,包括Alpha變異株(B.1.1.7)、Beta變異株(B.1.351)、Gamma變異株(P1)、Delta變異株(B.1.617.2)和Omicron變異株 (B.1.1.529)。
點擊看圖輯
科大理學院生命科學部助理教授黨尚宇教授(左)及港大愛滋病研究所所長兼港大醫學院臨床醫學學院微生物學系陳志偉教授(右)。
科大及港大聯合研究證明廣譜中和抗體,可保護倉鼠免受Omicron變異株感染。

香港大學。資料圖片
重要的是,在預防或治療情況下用藥,ZCB11可分別保護敘利亞倉鼠的肺部免受Omicron和Delta病毒變異株的攻擊。此外,科大合作團隊利用單顆粒冷動電鏡技術,在原子分辨率水平上解析了ZCB11和病毒刺突蛋白的複合結構,揭示了ZCB11獨特的分子作用模式,為接下來結構導向的抗體及改良疫苗奠定了堅實的基礎。

資料圖片
領導這項研究的港大愛滋病研究所所長、臨床醫學學院微生物學系教授陳志偉教授表示,研究結果顯示ZCB11 是一種很有醫用潛力的抗體藥物,可通過生物醫學干預,以應對大流行的SARS-CoV-2關注變異株。他補充指:「儘管研究結果表明港大醫學團隊在針對COVID-19的人類抗體藥物和疫苗的研發方面處於世界前沿,但我們仍迫切需要在香港建立大規模生產基地和臨床轉化中心,以達成晉身國際創新中心的目標。」
科大理學院生命科學部助理教授黨尚宇教授亦表示,高分辨率的結構信息能夠使團隊了解在眾多SARS-CoV-2關注變異株中,ZCB11具有廣譜中和作用的分子機制。
科大及港大聯合研究證明廣譜中和抗體,可保護倉鼠免受Omicron變異株感染。
香港大學(港大)工程學院團隊利用全港基因數據,研發一項嶄新的基因組追蹤方法,以精準追蹤耐藥細菌和耐藥基因在本港不同環境的流動和傳播途徑,為公共衛生防護策略提供關鍵啟示。
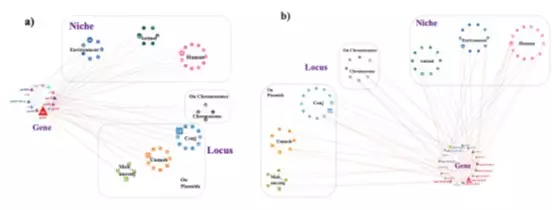
高風險耐藥基因的跨部門傳播及其基因組背景
由港大土木工程系張彤教授領導的研究團隊,針對本港河流及污水等城市水體中常見、可產生抗生素耐藥性的大腸桿菌展開研究。團隊同時追蹤細菌菌株及攜帶耐藥基因的質粒(小型基因片段),從而了解耐藥性在人、動物與環境之間的傳播機制。
團隊採用納米孔長讀長測序技術(Nanopore long-read sequencing),分析一年內收集的1,016個大腸桿菌樣本。這些樣本涵蓋不同細菌類型、耐藥基因及環狀質粒,讓研究人員能夠進行全港高解析度的比對分析。
研究發現,不同來源的細菌在基因上高度相似,其中142組相同菌株同時存在於人體與環境水體中。團隊更識別出195個同時存在於人類、動物及環境的質粒,顯示耐藥基因能透過可移動DNA傳播。實驗室實驗證實,部分質粒能在細菌間轉移,為跨界傳播提供了實證支持。
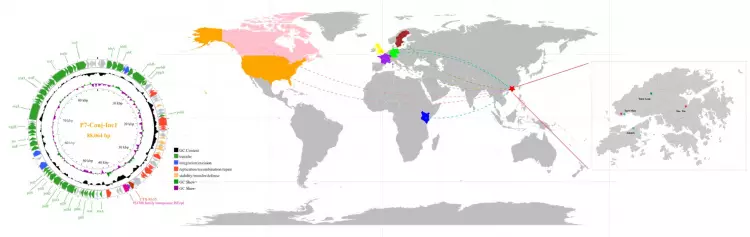
抗性質粒的區域與全球尺度傳播
此研究將複雜基因數據轉化為實用工具,建立創新量化框架,用以測量細菌與耐藥基因在不同環境間的連通性。簡言之,城市水體成為細菌與耐藥基因在人、動物與環境之間混合傳播的交匯點。
研究第一作者徐曉慶博士表示:「微生物耐藥不僅關乎基因分佈的位置,更關乎它們在彼此連通的環境之間如何移動。透過量化人類、動物與環境水體之間的生態連通性,這項研究有助解釋耐藥性傳播途徑,並為更一體化的監測與干預策略提供依據。」
這項發現對公共衛生而言是至關重要。當環境相互連通時,耐藥性將更快在人與環境間雙向傳播。研究支持建立綜合監測系統,整合污水、環境及臨床數據,幫助決策者及早預警並優先處理高風險質粒與菌株。此方法亦適用於其他城市,有助建立標準化基因組監測框架,在「同一健康」理念下評估及防控抗生素耐藥風險。
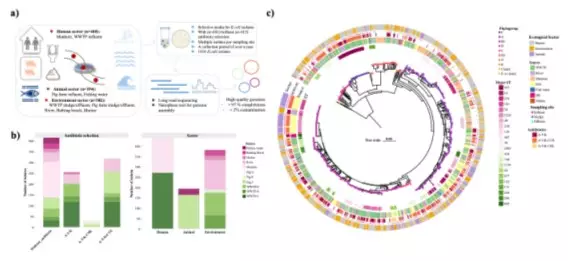
城市來源 E. coli 的採樣設計、分離株多樣性與基因組重建概覽
本研究獲張彤教授主持的大學教育資助委員會主題研究計劃(Theme-based Research Scheme, TRS)資助,相關計劃旨在支持本地資助大學圍繞戰略重點主題開展高水平科研。
研究成果已發表於國際權威期刊《自然-通訊(Nature Communications)》,論文題為「Ecological connectivity of genomic markers of antimicrobial resistance in Escherichia coli in Hong Kong」。
文章連結:https://doi.org/10.1038/s41467-025-62455-w