3天前(12月2日),英國成為全球首個批准使用美國輝瑞疫苗的國家,而美國的食品藥品監督管理局(FDA)仍未批准這隻以mRNA核酸技術製成的全新疫苖上市。
隨後多名英國內閣官員對自己高速批准疫苖這個「創舉」開始自信心爆棚,接連說出諸如「英國引導全人類抗疫」、「首批疫苗是因為我們比美國強」等言論。值得一提,英國這次搶批的,是美國輝瑞公司和德國BioNTech公司合作研發的新冠疫苗,非英國本土研發產品,英國牛津大學研製的腺病毒載體疫苖還未發展到可獲批准上市的水平。
英國的官員們沈浸在一種「國家自豪感」之中。
在疫苗獲准後,英國商務大臣夏爾馬稱,這項授權是英國的一項成就。他說:「在未來的幾年里,我們將把這一刻記為英國領導全人類抗擊這一疾病的日子。」
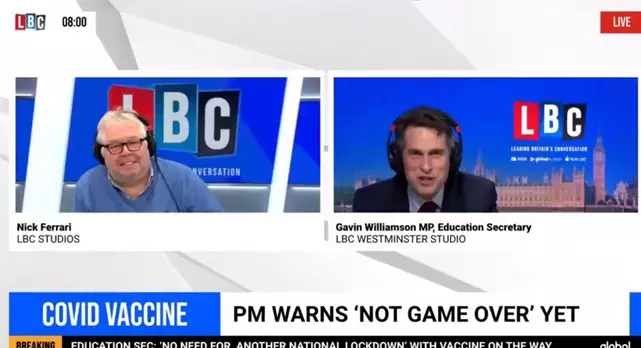
英國教育大臣加文·威廉森在節目中稱,「這是因為我們國家有最好的人才,最好的醫療法規——比法國好得多、比利時好得多、比美國好得多。比他們任何一個國家都強得多,不是嗎?」
但英國內閣成員這種盲目自豪,惹來批評,包括英國的自己人。
「這種疫苗民族主義,無論在新冠疫情中,還是在其他國際重大的公共衛生事件中,都是不應該的,」英國政府科學顧問傑里米·法拉(Jeremy Farrar)批評幾名英國官員時表示,「對於這種可怕的全球疫災,科學始終是最重要的——科學是無國界的。」
英國「秒批」疫苗的行為,亦遭歐盟多國反唇相譏。歐盟藥品管理局(EMA)罕見地發表了一份態度堅定的聲明表示,英國將速度置於贏得公眾信任之前,所以才能第一個批准疫苗。EMA還稱,歐盟成員國也可以選擇採取同樣的緊急授權途徑,但歐盟自身的程序是「在當前疫情大流行的緊急情況下,最合適的監管機制。」
歐洲議會議員、德國衛生部長等多位官員,均對英國「搶速度」的做法表示質疑。
此外,美國頂級傳染病學家安東尼·福奇也質疑,英國的藥監機構沒有向美疾控中心(CDC)那樣「謹慎行事」。福奇接受美國哥倫比亞廣播公司(CBS)採訪時表示,英國批准疫苗操之過急。
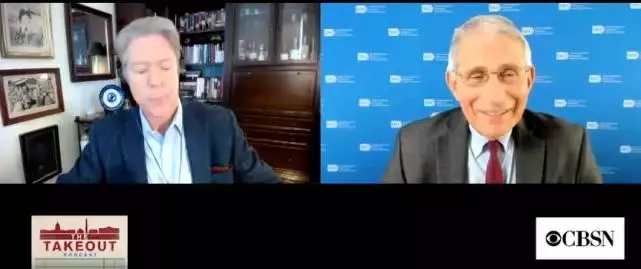
福奇接受CBS採訪稱英國「倉促」批疫苗
「他們(英國)就像在馬拉松比賽最後一公里前的角落里兜圈,然後突然加入進來一樣,」福奇對CBS華盛頓首席記者表示,「他們批准得太過倉促。」
接著,福奇質疑英國的藥監機構,並沒有「像美國食品藥品監督管理局(FDA)那樣謹慎地審查數據、做臨床測試。」
「美國FDA,才是藥品監管的典範(gold standard),」福奇稱,「英國沒有認真做(審查),所以才取得了幾天的領先。」
「如果我們太過草率,不合時宜地爭取個一周、一周半的時間,我覺得這會損傷FDA的公信力和監管程序。」

《紐約時報》12月3日報道,英美官員就「疫苗民族主義」發生爭執。
之後福奇還質疑,為何英國科學家只看輝瑞/BioNTech的「紙面數據」,從而判斷疫苗功效,而不花時間獨立審查疫苗效果,並提及「英國同樣遭到來自歐盟官員的批評。」
雖然後來福奇接受英國BBC訪問,為他批評英國致歉。福奇解釋自己稍早前言論,「我當時想表達的其實是,在美國,有很大的一股力量在質疑疫苗的可信性、安全性和效果。如果我們在美國也像英國那麼快(批准輝瑞疫苗)的話——我對英國的做法沒有任何看法——例如,如果我們昨天或者明天也批准疫苗的話,肯定會遭到強烈反對,我覺得在美國社會,對於疫苗的整個過程,瀰漫著太過強烈的懷疑主義。」
福奇顯然不想得罪英國,所以才打圓場。但英國的疫苖民族主義,已暴露了這個國家的決策是何等的輕率。
深喉
** 博客文章文責自負,不代表本公司立場 **







