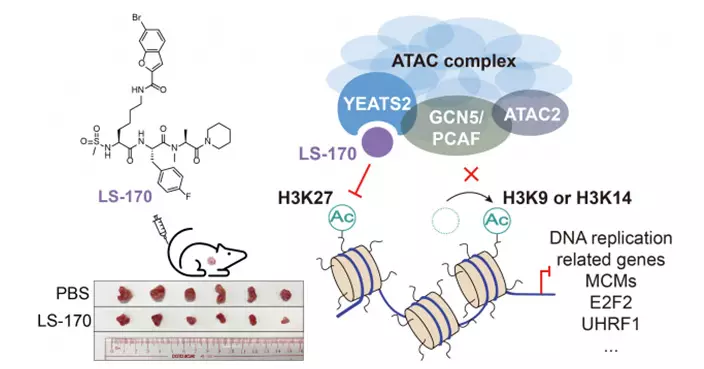
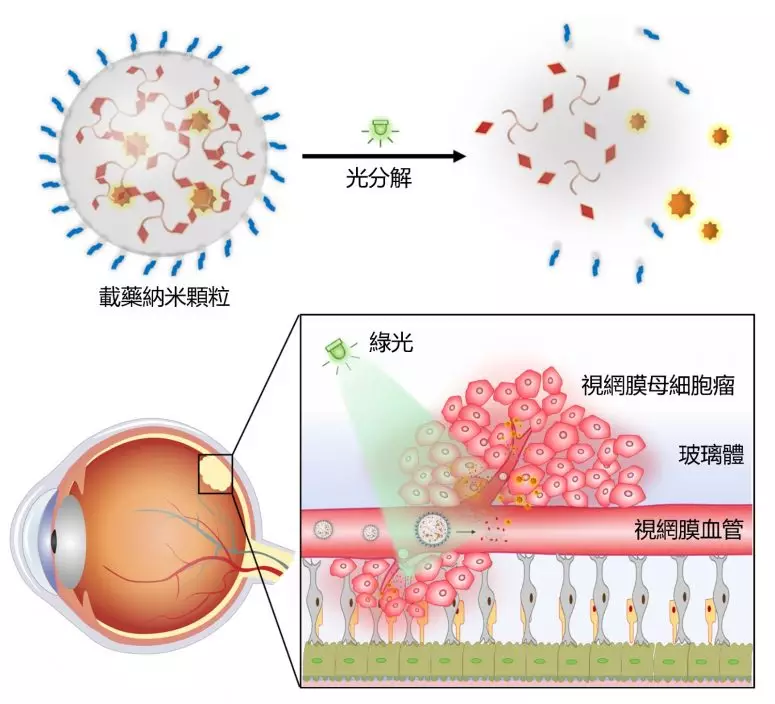
香港大學醫學院與上海復旦大學基礎醫學院的研究團隊合作研發「靜脈注射加光照觸發眼部釋藥」策略,成功將藥物結集於眼部視網膜母細胞瘤,為治療眼部腫瘤提供有效的非侵入性藥物遞送途徑。今次是團隊首次將光響應釋藥的納米藥物用於治療眼部疾病,具有廣泛應用前景。
研究團隊設計可被光分解的三枝狀小分子。港大圖片
研究團隊發現,靜脈注射光響應納米藥物後,用光照觸發眼內藥物釋放,可以使藥物在眼內結集並抑制腫瘤的生長。該策略主要基於疏水性藥物在視網膜血管中釋放後,能夠滲入腫瘤組織的特性,克服納米載體於藥物遞送過程中所遭遇的血液—視網膜屏障。
點擊看圖輯
港大醫學院藉光照觸發釋藥系統,取得視網膜母細胞瘤治療新突破。港大圖片

港大醫學院藉光照觸發釋藥系統,取得視網膜母細胞瘤治療新突破。港大圖片
研究團隊設計簡單且可被光分解的三枝狀小分子,該分子可以與疏水性藥物在水溶液中自發組裝形成納米顆粒,並能在綠光照射下分解及釋放藥物。在患有原位視網膜母細胞瘤的小鼠身上,透過靜脈注射納米顆粒並以綠光照射其眼部,可以有效抑制腫瘤生長,且未見毒副作用。

資料圖片
是項研究通過光照觸發釋藥系統,使透過靜脈注射的藥物能在視網膜母細胞瘤中結集,為該腫瘤的治療提供了安全有效的新方法。這項新技術也有助進一步發展精準藥物遞送,以便日後用於治療其他眼部疾病。 有關研究成果已在期刊《先進科學》(Advanced Science)發表,並已申請專利合作條約(PCT)專利。

香港大學。資料圖片
香港大學(港大)工程學院電機及電子工程學系的褚智勤副教授與機械工程系林原教授帶領的團隊,開發出「邊緣暴露剝離」的創新技術,突破了材料科學與半導體產業數十年來的製造瓶頸,成功實現以低成本、高效率的方法,大規模生產大尺寸、超平坦且具柔性的鑽石薄膜。此研究成果已於國際頂尖學術期刊《自然》(Nature)發表,並榮獲了由德國跨界基金會(Falling Walls Foundation)頒發的2025年度「科學突破獎」和日內瓦國際發明展金獎等多項國際榮譽,標誌著鑽石半導體技術從實驗室走向商業化之路。

港大革命性鑽石薄膜突破行業痛點
突破行業痛點:成本與規模化的雙重瓶頸
鑽石不僅是珍貴的珠寶原材料,更被譽為「終極半導體材料」,擁有極高的導熱性及電荷遷移率,使其成為理想的半導體材料。傳統合成鑽石薄膜的方法成本高、生產速度慢、尺寸受限、且表面平整度不足,嚴重限制了其商業應用與產業發展。港大團隊徹底改寫了鑽石薄膜的生產邏輯。此技術能夠在短短10秒內生產出2英寸大小的鑽石晶圓,且生產成本僅為傳統方法的千分之一。相比過去昂貴、耗時且難以擴展的製程,此突破不僅實現了工業級的速度與規模,更確保了產品具備原子級超平整表面與優異柔韌性,為微納米級精密製造與柔性電子應用奠定了基礎。此技術應用前景廣泛,可涉及高功率電子、量子技術、先進射頻系統及光電子學等領域。

鑽石薄膜產品展示

鑽石薄膜產品展示
三大核心技術釋放鑽石全方位潛力
• 成本下降 - 生產成本降至以往技術的千分之一,使鑽石從昂貴的實驗室材料轉變為可負擔的工業級組件。
• 高速、可擴展的工業化製程 - 製程快速、穩定且易於擴展,已具備即時產業化的條件,推動技術從實驗室走向廣泛商用。
• 無瑕、柔韌、超平整的產品特性 - 所得鑽石薄膜無瑕疵、可彎曲,且表面極度平整,滿足高精度光電與半導體製程的嚴苛要求。

#4 Edge-Exposed Exfoliation Diagram
褚智勤教授表示:「我們創立的鑽耐科思有限公司(DiamNEX)致力促進鑽石膜材料研發、生產和商業化應用,其技術及發展前景也在市場獲得了高度認可。公司於去年第三季度已順利完成逾千萬天使輪融資,目前,正全力推進產業化布局。我們期望與學術以及產業夥伴合作,將這項革命性的產品推向市場,加速鑽石時代的到來。」

褚智勤副教授(左)與林原教授
港大致力推動研究、創新、策略合作及創業支援,促進世界級的跨學科協作與知識交流,將前沿研究成果轉化為具影響力的實用方案,以應對當前社會挑戰,創造長遠價值,惠及社群。